Perbedaan Utama – Asam Kuat vs Asam Lemah. Asam adalah molekul atau spesies lain yang dapat menyumbangkan proton atau menerima pasangan elektron dalam reaksi. Asam diklasifikasikan menjadi dua kelompok yang dikenal sebagai asam kuat dan asam lemah.
Perbedaan utama antara asam kuat dan lemah adalah bahwa asam kuat terdisosiasi sepenuhnya dalam larutan berair sedangkan asam lemah sebagian berdisosiasi dalam larutan berair.
Pengertian Asam Kuat
Asam kuat adalah molekul yang benar-benar terdisosiasi menjadi ion mereka ketika berada di dalam air. Dengan kata lain, asam melepaskan ion H+ ke dalam larutan dengan ionisasi lengkapnya. Kekuatan asam dicirikan oleh nilai konstanta disosiasi asam (Ka). Biasanya, asam kuat memiliki nilai K yang sangat besar.
Semakin kuat asam, semakin mudah kehilangan proton. Proton-proton ini mudah dilepaskan karena polaritas ikatan yang tinggi antara atom H dan molekul lainnya. Polaritas ini ditentukan oleh elektronegativitas dua atom yang terlibat dalam ikatan ini. Deprotonasi (penghilangan proton) dari asam kuat tergantung pada polaritas dan ukuran anion yang melekat pada proton.
Sebagai contoh, jika asam yang disebut HA dipertimbangkan, disosiasi asam HA dapat diberikan sebagai,
HA (aq) + H 2 O (l) à A – (aq) + H 3 O + (aq)
Tetapi jika molekul asam memiliki lebih dari satu proton yang dapat dilepaskan, dapat ditunjukkan seperti di bawah ini. Contoh di bawah ini menunjukkan disosiasi asam diprotik. Ini berarti ia dapat melepaskan dua proton.
H 2 B (aq) + H 2 O (l) à B 2- (aq) + H 3 O + (aq)
Di sisi lain, pH larutan sangat dipengaruhi oleh asam kuat karena asam kuat melepaskan ion H + ke larutan. PH tergantung pada konsentrasi H +. Hubungan antara konsentrasi H + dan pH dapat diberikan seperti di bawah ini.
pH = -log [H + (aq) ]
Jika asam adalah asam kuat, nilai pH adalah nilai yang sangat kecil. Misalnya, jika asam monoprotik yang kuat ada dalam air pada konsentrasi 0,1 molL -1, pH larutan akan menjadi,
pH = -log [H + (aq) ]
pH = -log [0,1 molL -1 ]
= 1
Contoh Asam Kuat
- Asam klorida (HCl)
- Asam nitrat (HNO3)
- Asam sulfat (H2SO4)
- Asam hidrobromik (HBr)
- Asam hidroodik (HI)
- Asam perklorat (HClO4)
- Asam klorat (HClO3)
Pengertian Asam Lemah
Asam lemah adalah molekul yang sebagian berdisosiasi menjadi ion dalam larutan berair. Asam lemah tidak melepaskan semua ion H+ ke larutan. Konstanta disosiasi asam (Ka) adalah nilai yang lebih kecil daripada asam kuat. PH larutan sekitar 3-5. Itu karena asam lemah tidak meningkatkan konsentrasi H + suatu larutan seperti halnya asam kuat. Dalam sistem asam lemah dalam air, ada ion H+, anion molekul dan molekul asam lemah hadir dalam larutan.
Sebagai contoh, disosiasi asam etanoat dapat ditunjukkan seperti di bawah ini.
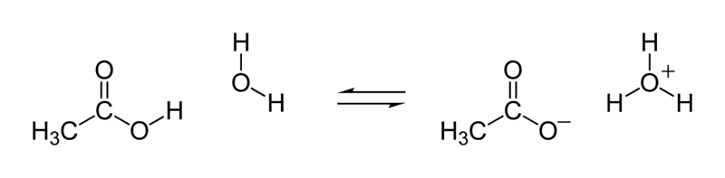
Saat menulis pemisahan asam lemah, seseorang harus menggunakan panah ganda alih-alih panah tunggal. Ini untuk menunjukkan reaksi adalah reaksi kesetimbangan.
Contoh Asam Lemah
- Asam sulfat (H2SO3)
- Asam fosfat (H3PO4)
- Asam fluorida (HF)
- Asam nitrat (HNO2)
- Asam benzoat (C6H5COOH)
- Asam format (HCOOH)
- Asam asetat (CH3COOH)
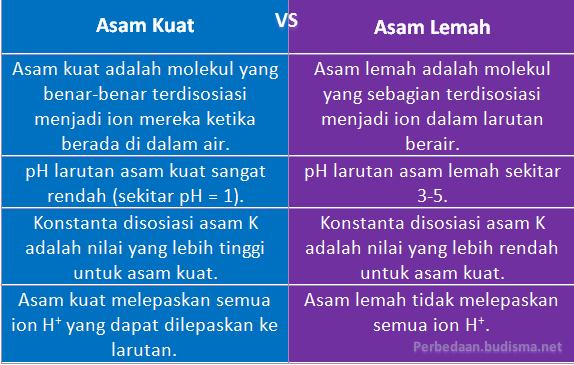
Perbedaan Antara Asam Kuat dan Asam Lemah
Definisi
- Asam Kuat: Asam kuat adalah molekul yang benar-benar terdisosiasi menjadi ion mereka ketika berada di dalam air.
- Asam Lemah: Asam lemah adalah molekul yang sebagian terdisosiasi menjadi ion dalam larutan berair.
pH
- Asam Kuat: pH larutan asam kuat sangat rendah (sekitar pH = 1).
- Asam Lemah: pH larutan asam lemah sekitar 3-5.
Konstan Disosiasi Asam
- Asam Kuat: Konstanta disosiasi asam K adalah nilai yang lebih tinggi untuk asam kuat.
- Asam Lemah: Konstanta disosiasi asam K adalah nilai yang lebih rendah untuk asam kuat.
Jumlah Ion H+ yang dilepas
- Asam Kuat: Asam kuat melepaskan semua ion H+ yang dapat dilepaskan ke larutan.
- Asam Lemah: Asam lemah tidak melepaskan semua ion H+.
Kesimpulan
Kekuatan asam ditentukan oleh polaritas dan ukuran atom molekul asam. Menurut cara molekul asam berdisosiasi dalam air, ada dua jenis asam sebagai asam kuat dan asam lemah. Perbedaan utama antara asam kuat dan lemah adalah bahwa asam kuat terdisosiasi sepenuhnya dalam larutan berair sedangkan asam lemah sebagian berdisosiasi dalam larutan berair.

