Perbedaan Utama – Teori Ikatan Valensi vs Teori Orbital Molekul. Sebuah atom terdiri dari orbital tempat elektron berada. Orbital atom ini dapat ditemukan dalam berbagai bentuk dan tingkat energi yang berbeda.
Ketika sebuah atom berada dalam sebuah molekul dalam kombinasi dengan atom-atom lain, orbital-orbital ini disusun dengan cara yang berbeda. Susunan orbital ini akan menentukan ikatan kimia dan bentuk atau geometri molekul. Untuk menjelaskan pengaturan orbital-orbital ini, kita dapat menggunakan teori ikatan valensi atau teori orbital molekul.
Perbedaan utama antara teori ikatan valensi dan teori orbital molekul adalah bahwa teori ikatan valensi menjelaskan hibridisasi orbital sedangkan teori orbital molekul tidak memberikan rincian tentang hibridisasi orbital.
Pengertian Teori Ikatan Valensi
Teori ikatan valensi adalah teori dasar yang digunakan untuk menjelaskan ikatan kimia atom dalam suatu molekul. Teori ikatan valensi menjelaskan pasangan elektron melalui orbital yang tumpang tindih. Orbital atom terutama ditemukan sebagai orbital s, orbital p, dan orbital d. Menurut teori ikatan valensi, tumpang tindih dua orbital s atau orbital p yang tumpang tindih akan membentuk ikatan sigma. Tumpang tindih dua orbital p paralel akan membentuk ikatan pi. Oleh karena itu, ikatan tunggal hanya akan mengandung ikatan sigma sedangkan ikatan rangkap akan berisi ikatan sigma dan ikatan pi. Ikatan rangkap tiga mungkin mengandung ikatan sigma bersama dengan dua ikatan pi.
Molekul sederhana seperti H 2 membentuk ikatan sigma hanya dengan tumpang tindih orbital karena atom hidrogen (H) hanya terdiri dari orbital s. Tetapi untuk atom yang terdiri dari orbital s dan p memiliki elektron tidak berpasangan, teori ikatan valensi memiliki konsep yang dikenal sebagai “hibridisasi”.
Hibridisasi orbital menghasilkan orbital hibrid. Orbital hibrid ini diatur sedemikian rupa sehingga tolakan antara orbital ini diminimalkan. Berikut ini adalah beberapa orbital hibrid.
Orbital sp
Orbital hibrid ini terbentuk ketika orbital hibridisasi dengan orbital ap. Oleh karena itu, orbital sp memiliki karakteristik orbital 50% dan 50% karakteristik orbital. Sebuah atom yang terdiri dari orbital sp hibrid memiliki dua orbital p un-hibridisasi. Oleh karena itu, kedua orbital p tersebut dapat tumpang tindih secara paralel membentuk dua ikatan pi. Pengaturan terakhir dari orbital hibridisasi adalah linear.
Orbital sp2
Orbital hibrid ini terbentuk dari hibridisasi orbital s dengan dua orbital p. Oleh karena itu, orbital hibrida sp2 ini terdiri dari sekitar 33% dari sifat orbital s dan sekitar 67% dari sifat orbital p. Atom-atom yang mengalami hibridisasi jenis ini terdiri dari satu orbital p un-hibridisasi. Pengaturan terakhir dari orbital hybrid adalah trigonal planar.
Orbital sp3
Orbital hibrid ini terbentuk dari hibridisasi orbital s dengan orbital p tiga. Oleh karena itu, orbital hibrida sp 3 ini terdiri dari sekitar 25% dari sifat orbital s dan sekitar 75% dari sifat orbital p. Atom yang mengalami hibridisasi jenis ini tidak memiliki orbital un-hibridisasi. Pengaturan terakhir dari orbital hibrid adalah tetrahedral.
Orbital sp3 d1
Hibridisasi ini melibatkan orbital s, tiga orbital p dan orbital ad.
Orbital hibrid ini akan menentukan geometri akhir atau bentuk molekul.
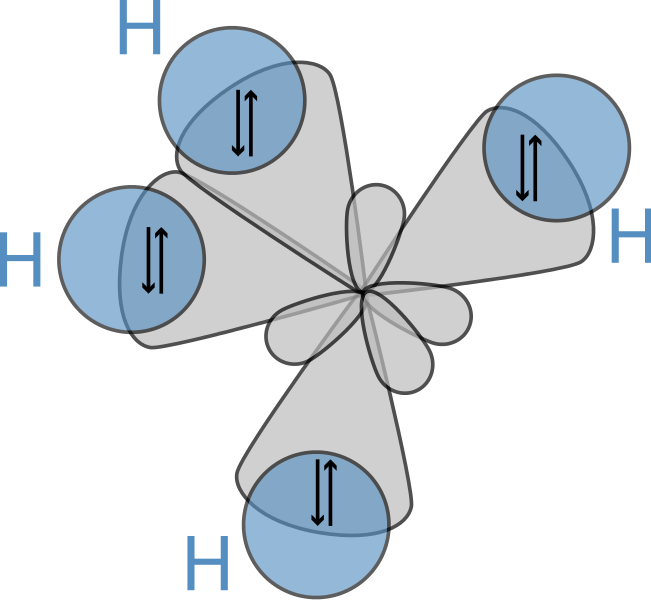
Gambar di atas menunjukkan geometri molekul CH4. Itu tetrahedral. Orbital berwarna abu adalah orbital sp 3 hibridisasi dari atom karbon sedangkan orbital berwarna biru adalah orbital s atom hidrogen yang telah tumpang tindih dengan orbital hibrid atom karbon yang membentuk ikatan kovalen.
Pengertian Teori Orbital Molekul
Teori orbital molekul menjelaskan ikatan kimia suatu molekul menggunakan orbital molekul hipotetis. Ini juga menjelaskan bagaimana orbital molekul terbentuk ketika orbital atom tumpang tindih (campuran). Menurut teori ini, orbital molekul dapat menampung maksimum dua elektron. Elektron ini memiliki putaran berlawanan untuk meminimalkan tolakan di antara mereka. Elektron ini disebut pasangan elektron ikatan. Sebagaimana dijelaskan dalam teori ini, orbital molekul dapat terdiri dari dua jenis: orbital molekul ikatan dan orbital molekul anti ikatan.
Orbit Molekul Ikatan
Orbital molekul ikatan memiliki energi yang lebih rendah daripada orbital atom (orbital atom yang berpartisipasi dalam pembentukan orbital molekul ini). Karena itu, orbital ikatan stabil. Orbital molekul pengikat diberi simbol σ.
Orbital Molekul Anti-Ikatan
Orbital molekul anti-ikatan memiliki energi yang lebih tinggi daripada orbital atom. Karena itu, orbital anti ikatan ini tidak stabil dibandingkan dengan orbital ikatan dan orbital. Orbital molekul antibonding diberi simbol σ *.
Orbital molekul ikatan menyebabkan pembentukan ikatan kimia. Ikatan kimia ini bisa berupa ikatan sigma atau ikatan pi. Orbital antibonding tidak terlibat dalam pembentukan ikatan kimia. Mereka tinggal di luar ikatan. Ikatan sigma terbentuk ketika tumpang tindih head-to-head terjadi. Ikatan pi terbentuk di dalam orbital yang tumpang tindih.
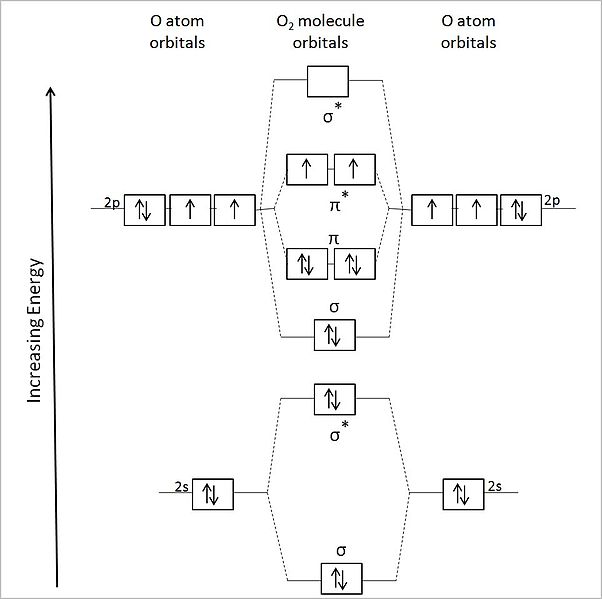
Dalam gambar di atas, orbital atom dari dua atom oksigen ditampilkan di sisi kiri dan kanan. Di tengah-tengah, orbital molekul molekul O2 ditunjukkan sebagai orbital ikatan dan anti ikatan.
Perbedaan Antara Teori Ikatan Valensi dan Teori Orbital Molekul
Definisi
- Teori ikatan valensi : Teori ikatan valensi adalah teori dasar yang digunakan untuk menjelaskan ikatan kimia atom dalam suatu molekul.
- Teori Orbital Molekul: Teori orbital molekul menjelaskan ikatan kimia suatu molekul menggunakan orbital molekul hipotetis.
Orbit Molekuler
- Teori Ikatan Valensi : Teori ikatan valensi tidak memberikan detail tentang orbital molekul. Ini menjelaskan ikatan orbital atom.
- Teori Orbital Molekul: Teori orbital molekul dikembangkan berdasarkan orbital molekul.
Jenis-jenis Orbit
- Teori Ikatan Valensi : Teori ikatan valensi menggambarkan orbital hibrid.
- Teori Orbital Molekul: Teori orbital molekul menggambarkan orbital molekul ikatan dan orbital molekul anti ikatan.
Hibridisasi
- Teori Ikatan Valensi : Teori ikatan valensi menjelaskan hibridisasi orbital molekul.
- Teori Orbital Molekul: Teori orbital molekul tidak menjelaskan tentang hibridisasi orbital.
Kesimpulan
Teori ikatan valensi dan teori orbital molekul digunakan untuk menjelaskan ikatan kimia antara atom dalam molekul. Namun, teori ikatan kelambu tidak dapat digunakan untuk menjelaskan ikatan dalam molekul kompleks. Ini sangat cocok untuk molekul diatomik. Tetapi teori orbital molekul dapat digunakan untuk menjelaskan ikatan dalam molekul apa pun. Oleh karena itu ia memiliki banyak aplikasi canggih daripada teori ikatan valensi. Ini adalah perbedaan antara teori ikatan valensi dan teori orbital molekul.

