Perbedaan utama: Molaritas, juga dikenal sebagai konsentrasi molar, mengukur jumlah mol suatu zat yang ada dalam per liter larutan. Molaritas dilambangkan dengan huruf kapital M. Molality mengukur jumlah mol suatu zat yang ada dalam per kilogram pelarut. Molalitas dilambangkan dengan huruf kecil m.

Istilah ‘molaritas’ dan ‘molalitas’ adalah dua istilah yang umum terdengar dalam kimia. Ini adalah dua unit yang digunakan untuk mengukur konsentrasi larutan. Konsep molaritas dan molalitas sangat membingungkan bagi orang-orang yang baru mempelajari istilah-istilah ini karena mereka tampak mirip dan keduanya digunakan sebagai ukuran. Namun, kedua istilah ini berbeda dalam cara mereka mengukur konsentrasi tertentu.
Kedua konsep tersebut mendasarkan perhitungan mereka pada berapa banyak mol yang ada dalam solusi saat ini. Suatu larutan dapat didefinisikan sebagai campuran homogen, yang berarti dua atau lebih komponen telah dicampur ke titik yang tidak dapat dibedakan dengan mata telanjang. Dua konsep ini membutuhkan pemahaman mol karena menentukan jumlah mol yang ada dalam solusi. Teori tahi lalat ditemukan oleh ilmuwan Italia, Amedeo Avogardo.
Pada tahun 1811, Avogardo mengusulkan bahwa volume gas, pada suhu dan tekanan tertentu, sebanding dengan jumlah atom atau molekul terlepas dari sifatnya. Konsep ini dikenal sebagai konstanta Avogardo. Ini didefinisikan sebagai jumlah partikel penyusun (biasanya atom atau molekul) dalam satu mol zat yang diberikan. Dalam istilah awam, satu mol suatu zat akan mewakili jumlah atom dan molekul yang ada dalam unsur tersebut. Misalnya: Oksigen memiliki berat atom 16, ini akan mewakili massa per mol oksigen. Jadi, satu mol oksigen akan memiliki massa 16 gram. Menurut Avogardo, satu mol oksigen akan memiliki jumlah atom yang sama dengan satu mol hidrogen. Namun, mereka dapat berbeda dalam berat.
Molaritas dan molalitas mengukur konsentrasi menggunakan dua pendekatan yang berbeda. Molaritas, juga dikenal sebagai konsentrasi molar, mengukur jumlah mol suatu zat yang ada dalam per liter larutan. Molaritas dilambangkan dengan huruf kapital M. Jadi solusi dengan 1.0M akan menyatakan bahwa ia mengandung 1 mol solut per liter larutan. Misalnya: Solusi air dan gula. Jika larutan diukur sebagai 1,0 M, maka larutan tersebut memiliki 1 mol gula per liter larutan yang ada. Molaritas juga dikenal sebagai konsentrasi jumlah zat, jumlah konsentrasi, konsentrasi zat atau hanya konsentrasi. Molaritas dapat dihitung dengan menggunakan rumus: M = mol (# mol) / L (volume larutan dalam liter).
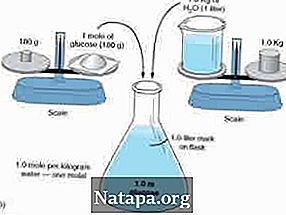
Molalitas mengukur jumlah mol suatu zat yang ada dalam per kilogram pelarut. Molalitas dilambangkan dengan huruf kecil m. Jadi solusi dengan 1.0m akan menyatakan bahwa ia mengandung 1 mol zat terlarut per kilogram pelarut. Mari kita bedakan zat terlarut dari zat pelarut. Zat terlarut adalah zat yang sedang larut ke dalam zat lain. Pelarut adalah zat yang melarutkan zat terlarut. Jadi, jika air dan gula dicampur bersama, gula akan menjadi zat terlarut dan menyirami pelarut. Air gula campur akan menjadi solusinya. Sekarang, dalam molalitas, sangat penting bahwa tahi lalat dibagi oleh massa pelarut dan bukan solusinya. Molalitas dapat dihitung dengan menggunakan rumus: m = mol (# mol) / KG (massa pelarut dalam kg).
Kenapa bedanya? Nah, keduanya digunakan saat berhadapan dengan suhu. Jika solusi akan berubah suhu maka molalitas digunakan. Tetapi untuk solusi yang akan tetap pada suhu konstan molaritas digunakan. Ini karena ketika suhu naik atau turun, volume larutan berubah dan ini secara langsung mempengaruhi molaritas. Oleh karena itu, molalitas digunakan untuk menghitung konsentrasi.
