Perbedaan Antara Orbit dan Orbital (Dengan Tabel)
Orang yang baru mengenal teori atom biasanya menemukan istilah “orbit” dan “orbital” yang sama. Namun, bukan itu masalahnya. Kedua istilah tersebut sangat berbeda satu sama lain dalam berbagai aspek.
Orbit vs Orbit
Perbedaan antara Orbit dan Orbital adalah bahwa orbit dianggap sebagai jalur pasti di mana elektron berputar, sedangkan Orbital adalah area yang tidak pasti, dan kemungkinan menemukan elektron di sini maksimum. Orbit adalah area dua dimensi atau datar. Namun, sebuah orbital mewakili area tiga dimensi di mana kemungkinan menemukan elektron adalah maksimum.

Orbit vs Orbit
Anda dapat menganggap elektron dalam atom sebagai planet di tata surya kita, dengan nukleus mewakili matahari. Elektron ini cenderung berputar di jalur yang disebut orbit. Saat elektron berputar mengelilingi orbitnya, mereka biasanya mengikuti semua prinsip yang diikuti planet saat berputar mengelilingi matahari.
Menurut prinsip ketidakpastian Heisenberg, posisi elektron tidak dapat ditentukan secara tepat. Untuk mewakili posisi elektron dalam atom, konsep orbital diperkenalkan.
Namun, orbital juga tidak menunjukkan kecepatan, arah, dan posisi elektron. Tapi itu memberikan gambaran yang akurat tentang di mana sebuah elektron berada.
Tabel Perbandingan Orbit vs. Orbital (dalam bentuk tabel)
Perbandingan Orbit vs Orbit
|
Definisi |
Sebuah jalur di mana elektron berputar di sekitar inti atom disebut orbit. |
Ruang tiga dimensi di mana peluang menemukan elektron cukup tinggi dikenal sebagai orbital. |
|
akurasi posisi |
Ini mewakili posisi yang tepat dari elektron dalam atom. |
Itu tidak dapat mewakili posisi yang tepat dari sebuah elektron. |
|
Awal dari ketidakpastian |
Sebuah orbit tidak mengikuti prinsip ketidakpastian Heisenberg, karena mengklaim menunjukkan posisi yang tepat dari sebuah elektron. |
Karena sebuah orbital tidak mewakili posisi yang tepat dari sebuah elektron, ia mengikuti prinsip ketidakpastian Heisenberg. |
|
Membentuk |
Setiap orbit memiliki bentuk lingkaran. |
Orbital memiliki bentuk yang berbeda: bulat, berbentuk lonceng, dll. |
|
Penamaan |
Orbit ditentukan oleh huruf K, L, M, N, dll. |
Orbital didefinisikan terutama dengan menggunakan huruf s, p, d, dan f. |
Apa itu Orbit?
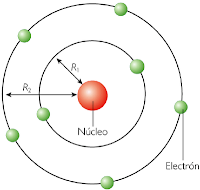
Orbit didefinisikan sebagai jalur yang didefinisikan secara melingkar, di mana elektron berputar karena tarikan yang dialami oleh elektron menuju inti bermuatan positif. Inilah yang dinyatakan oleh teori atom Bohr.
Model Bohr juga menyatakan bahwa kulit pertama atom hanya akan berisi 2 elektron. Namun, model Bohr kemudian ditolak.
Model yang saat ini diterima secara luas adalah model yang dibentuk oleh konsep orbital. Untuk memahami konsep orbit, Anda harus mengetahui tata surya.
Pikirkan seperti ini, planet-planet di tata surya mewakili elektron, yang berputar mengelilingi matahari, yang dalam hal ini adalah nukleus.
Sama seperti planet, elektron juga mengikuti hukum gerak Newton saat berputar mengelilingi nukleus.
Tidak seperti orbital, orbit hanyalah lintasan dua dimensi. Orbit tunggal dapat berisi hingga 2n2 elektron.
Menurut prinsip ketidakpastian Heisenberg, posisi elektron yang tepat adalah sesuatu yang tidak dapat ditentukan.
Di sinilah konsep orbital masuk.
 Apa itu Orbital?
Apa itu Orbital?
Posisi yang tepat dari sebuah elektron tidak dapat ditentukan, seperti yang dinyatakan dalam prinsip Heisenberg. Inilah yang memperkenalkan kita pada orbital.
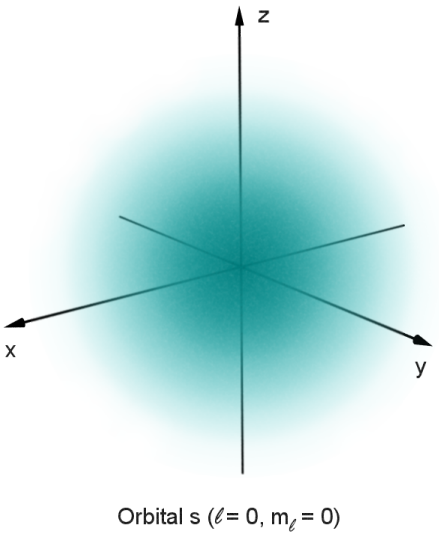
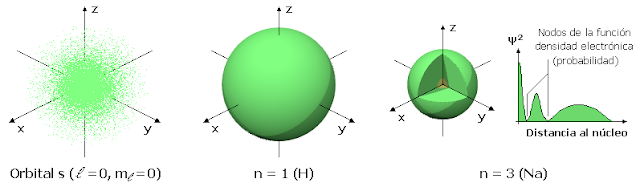
Orbital adalah area tidak pasti yang mewakili peluang maksimum untuk menemukan elektron di sana. Ruang tiga dimensi di sekitar nukleus mewakili orbital.
Orbital memiliki beberapa jenis bentuk. Orbital umumnya diklasifikasikan dalam empat cara: s, p, d, dan f. Orbital s memiliki kapasitas maksimum untuk menampung 2 elektron, p dapat menampung hingga 6 elektron, d dapat menampung 10 elektron, sedangkan f dapat menampung 16 elektron.
Di wilayah tiga dimensi atom, kemungkinan menemukan elektron cukup tinggi, katakanlah 95 persen.
Dalam orbital, cukup mudah untuk menentukan bentuk molekul karena terarah. Orbital sebagian besar didasarkan pada prinsip Heisenberg.
Perbedaan utama antara orbit dan orbit
- Orbit adalah jalur yang ditentukan di mana elektron berputar. Namun, orbital adalah jalur tiga dimensi di mana peluang menemukan elektron cukup tinggi.
- Orbit dimaksudkan untuk mewakili posisi yang tepat dari sebuah elektron dalam atom, sedangkan orbital tidak dimaksudkan untuk menggambarkan posisi yang tepat dari elektron.
- Gerakan dua dimensi atau bidang elektron berada di orbit. Namun, elektron bergerak dalam ruang tiga dimensi di sekitar inti dalam sebuah orbital.
- Karena Orbit mengklaim untuk mengetahui posisi elektron yang tepat, itu tidak sesuai dengan prinsip ketidakpastian Heisenberg.
Orbital tidak menentukan posisi elektron dan dapat berada di mana saja dalam ruang 3D tersebut. Oleh karena itu, cocok dengan prinsip Heisenberg. - Tak satu pun dari orbit menunjukkan fitur termasuk arah, sedangkan dalam kasus orbital, fitur terarah dapat dilihat, kecuali orbital s.
Pertanyaan yang Sering Diajukan (FAQ) tentang Orbit dan Orbital
- Bagaimana bentuk orbital d?
Orbital d berbentuk seperti daun semanggi karena elektron dikeluarkan empat kali selama rotasi ketika sebuah proton dengan spin berlawanan menyelaraskan gluon dengan tiga proton spin sejajar.
- Apa aturan Hund?
Setiap orbital dalam subkulit secara individual ditempati oleh sebuah elektron sebelum orbital mana pun ditempati dua kali, dan semua elektron dalam orbital yang ditempati secara individual memiliki spin yang sama. Ini ditetapkan oleh aturan Hund.
- Apa perbedaan antara orbit dan orbit Bohr?
Menurut orbital Bohr, orbit pertama hanya mampu menampung dua elektron.
Ketika berbicara tentang orbital normal, itu adalah fungsi matematika yang digunakan untuk menggambarkan elektron atau pasangan elektron dalam suatu orbit.
- Apa perbedaan utama antara orbital 2p dan 3p?
Orbital 3p memiliki dua bidang nodal, sedangkan orbital 2p hanya memiliki satu bidang nodal.
Orbital 3p lebih jauh dari inti daripada orbital 2p. Dan orbital 3p memiliki bentuk yang berbeda dari orbital 2p.
- Bagaimana bentuk orbital f?
Orbital f dapat menampung total 15 elektron dalam orbitalnya. Bentuk orbital f berbentuk tetrahedral.
Orbital ini sedikit lebih kompleks, tetapi juga mengikuti aturan yang sama untuk elektron yang diikuti dalam orbital p dan d.
- Apa hukum pertama Kepler?
Hukum pertama menyatakan bahwa planet bergerak dalam orbit elips, dengan Matahari sebagai fokus elips.
Hukum ini mengidentifikasi bahwa jarak antara Matahari dan Bumi terus berubah saat Bumi berputar mengelilingi orbitnya.
- Apa saja ketiga jenis orbit tersebut?
Orbit adalah jalur di mana Bumi atau planet lain bergerak untuk menyelesaikan rotasi atau revolusinya sendiri.
Tiga jenis orbit adalah: Orbit Bumi Tinggi, Orbit Bumi Sedang, dan Orbit Bumi Rendah.
Kesimpulan
Orbit dan Orbital adalah dua istilah yang berbeda, dan keduanya terkait dengan atom. Konsep orbit atom persis sama dengan konsep planet yang berputar mengelilingi matahari di tata surya.
Elektron yang mengorbit sepenuhnya mengikuti hukum gerak Newton. Namun, mereka tidak sejalan dengan prinsip ketidakpastian Heisenberg.
Orbital mewakili ruang 3D di sekitar nukleus di mana probabilitas menemukan elektron cukup tinggi. Ini sepenuhnya mengikuti prinsip ketidakpastian Heisenberg.
Menurut prinsip ketidakpastian Heisenberg, tidak ada cara yang mungkin untuk secara akurat menentukan gerak, kecepatan, dan arah elektron dalam atom.
Yang bisa Anda dapatkan hanyalah representasi kasar di mana Anda dapat menemukan elektron di dalam atom.
Awan kata untuk membedakan antara orbit dan orbit
Berikut ini adalah kumpulan istilah yang paling banyak digunakan dalam artikel ini tentang Orbit dan Orbital . Ini akan membantu Anda mengingat istilah terkait seperti yang digunakan dalam artikel ini di tahap selanjutnya.

Awan kata untuk orbit dan orbit
Referensi
- https://www.birpublications.org/doi/pdf/10.1038/sj/dmfr/4600551
- https://www.oto.theclinics.com/article/S0030-6665(11)00102-2/abstrak
