Perbedaan Utama – Elektron Ikatan vs Elektron Bebas. Setiap elemen memiliki elektron dalam atomnya. Elektron-elektron ini berada dalam cangkang yang terletak di luar nukleus. Satu cangkang dapat memiliki satu orbital atau lebih. Orbital yang paling dekat dengan nukleus adalah s, p dan d orbital.
Orbital dapat dibagi menjadi beberapa sub-orbital. Satu sub-orbital dapat menampung maksimum dua elektron. Ketika tidak ada elektron, itu disebut orbital kosong. Ketika ada satu elektron dalam sub-orbital, itu disebut elektron tidak berpasangan. Ketika sub-orbital diisi dengan maksimum dua elektron, itu disebut pasangan elektron. Pasangan elektron dapat ditemukan dalam dua jenis sebagai elektron ikatan dan elektron bebas.
Perbedaan utama antara elektron ikatan dan elektron bebas adalah bahwa elektron ikatan terdiri dari dua elektron yang ada dalam ikatan sedangkan elektron bebas terdiri dari dua elektron yang tidak terikat.
Pengertian Elektron Ikatan
Elektron ikatan adalah pasangan elektron yang ada dalam ikatan. Ikatan tunggal selalu terdiri dari dua elektron yang berpasangan satu sama lain. Kedua elektron ini bersama-sama disebut elektron ikatan. Elektron ikatan dapat dilihat pada senyawa kovalen dan senyawa koordinasi. Dalam senyawa kovalen, ikatan kovalen terdiri dari elektron ikatan. Dalam senyawa koordinasi, ikatan koordinasi terdiri dari elektron ikatan.
Dalam senyawa koordinasi, ligan menyumbangkan pasangan elektron tunggal mereka ke atom logam pusat. Meskipun mereka adalah pasangan mandiri, mereka membentuk ikatan koordinasi yang mirip dengan ikatan kovalen setelah sumbangan; karenanya mereka dianggap sebagai elektron ikatan. Ini karena kedua elektron dibagi di antara dua atom.
Dalam senyawa kovalen, dua atom berbagi elektron yang tidak berpasangan untuk membuat mereka berpasangan. Pasangan elektron ini disebut elektron ikatan. Ketika ada ikatan rangkap dua atau rangkap tiga, ada pasangan ikatan per masing-masing ikatan. Misalnya, jika ada ikatan rangkap dua, ada dua pasangan ikatan. Karena ikatan kovalen terbentuk melalui hibridisasi orbital dua atom, pasangan ikatan berada dalam orbital hibridisasi. Orbital hibridisasi ini dapat membentuk ikatan sigma atau ikatan pi. Oleh karena itu elektron ikatan dapat diamati dalam ikatan sigma atau ikatan pi.
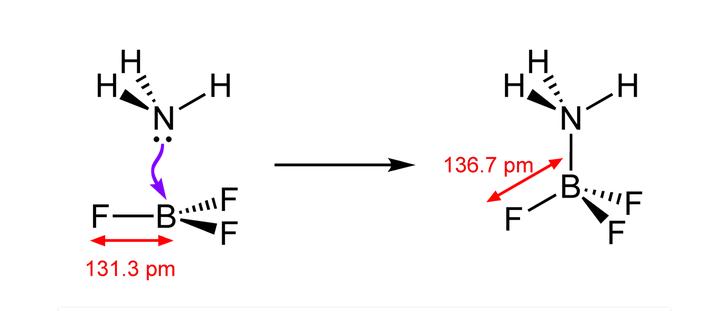
Dalam contoh di atas, pasangan elektron pada atom N molekul NH3 disumbangkan ke atom B molekul BF3. Setelah itu, ikatan koordinasi terlihat seperti ikatan kovalen. Oleh karena itu, pasangan elektron sekarang menjadi elektron ikatan.
Pengertian Elektron Bebas
Elektron bebas adalah pasangan elektron yang tidak terikat. Elektron dari pasangan elektron bebas memiliki atom yang sama. Oleh karena itu, pasangan elektron bebas juga disebut pasangan elektron non-ikatan. Meskipun elektron dalam kulit paling dalam juga digabungkan dan tidak berpartisipasi dalam ikatan, mereka tidak dianggap sebagai pasangan mandiri. Elektron valensi dari suatu atom yang digabungkan satu sama lain dianggap sebagai pasangan elektron bebas.
Terkadang elektron bebas ini dapat disumbangkan ke atom lain yang memiliki orbital kosong. Kemudian membentuk ikatan koordinasi. Setelah itu, itu tidak dianggap sebagai elektron bebas karena menjadi elektron ikatan. Beberapa elemen hanya memiliki satu elektron bebas. Beberapa elemen lain memiliki lebih dari satu elektron bebas.
Sebagai contoh, Nitrogen (N) dapat membentuk maksimum tiga ikatan kovalen. Tetapi jumlah elektron valensi yang dimilikinya adalah 5. Oleh karena itu, tiga elektron dibagi dengan atom lain untuk membentuk ikatan sedangkan dua elektron lainnya tetap sebagai pasangan elektron bebas. Tetapi halogen memiliki 7 elektron di orbital terluarnya. Oleh karena itu, mereka memiliki 3 pasangan elektron bersama dengan satu elektron tidak berpasangan. Oleh karena itu, halogen dapat memiliki satu ikatan kovalen dengan berbagi elektron yang tidak berpasangan ini.
Elektron bebas mengubah sudut ikatan dalam molekul. Misalnya, perhatikan molekul linier yang tersusun dari atom pusat yang memiliki dua ikatan. Jika tidak ada elektron bebas, molekul akan tetap sebagai molekul linier. Tetapi jika ada satu atau lebih pasangan elektron bebas pada atom pusat, molekulnya tidak lagi linier. Karena tolakan yang disebabkan oleh elektron bebas, elektron ikatan ditolak. Kemudian molekul menjadi bersudut bukan linier.
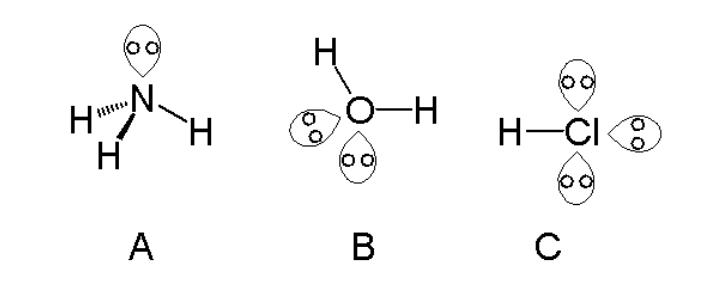
Seperti yang ditunjukkan pada gambar di atas, amonia memiliki satu pasangan elektron bebas, molekul air memiliki 2 pasangan elektron bebas dan HCl memiliki 3 pasangan elektron bebas.
Jika sebuah atom memiliki orbital kosong, pasangan elektron bebas dapat dipecah menjadi elektron yang tidak berpasangan melalui hibridisasi orbital dan dapat berpartisipasi dalam ikatan. Tetapi jika tidak ada orbital kosong, pasangan elektron bebas akan tetap sebagai pasangan elektron dan tidak berpartisipasi dalam ikatan.
Perbedaan Antara Elektron Ikatan dan Elektron Bebas
Definisi
- Elektron Ikatan: Elektron ikatan adalah pasangan elektron yang berada dalam ikatan.
- Elektron Bebas: Elektron bebas adalah pasangan elektron yang tidak terikat.
Ikatan
- Elektron Ikatan: Elektron ikatan selalu dalam ikatan.
- Elektron Bebas: Elektron bebas tidak dalam ikatan tetapi dapat membentuk ikatan dengan menyumbangkan pasangan bebas (ikatan koordinasi).
Atom
- Elektron Ikatan: Dua elektron milik dua atom dalam elektron ikatan.
- Elektron Bebas: Kedua elektron milik atom yang sama dalam elektron bebas.
Asal
- Elektron Ikatan: Elektron ikatan dibuat karena berbagi elektron oleh dua atom.
- Elektron Bebas: Elektron bebas dibuat karena tidak adanya orbital kosong.
Kesimpulan
Elektron ikatan dan elektron bebas adalah dua istilah yang digunakan untuk menggambarkan elektron berpasangan. Pasangan elektron ini menyebabkan reaktivitas, polaritas, keadaan fisik dan sifat kimia senyawa. Senyawa ionik mungkin atau tidak mungkin memiliki elektron ikatan dan elektron bebas. Senyawa kovalen dan senyawa koordinasi pada dasarnya memiliki elektron ikatan. Mereka mungkin atau mungkin tidak memiliki elektron bebas. Perbedaan antara elektron ikatan dan elektron bebas adalah bahwa elektron ikatan terdiri dari dua elektron yang berada dalam ikatan sedangkan elektron bebas terdiri dari dua elektron yang tidak terikat.

