Ikatan kimia terbentuk oleh interaksi antara bahan kimia. Mereka membentuk ikatan kovalen atau ikatan ionik. Pembentukan ikatan ini terjadi untuk mendapatkan stabilitas oleh reaktan.
Dalam pembentukan ikatan, elektron dilepaskan atau diambil atau dibagi dengan spesies bahan kimia yang terlibat dalam pembentukan ikatan. Namun terkadang, ikatan ini bisa putus. Pemecahan adalah penghancuran ikatan kimia kovalen. Ini membagi satu molekul menjadi dua bagian.
Pemecahan terdiri dari dua jenis: pemecahan homolitik dan pemecahan heterolitik. Pemecahan homolitik melibatkan pembentukan dua bagian yang sama, sedangkan pemecahan heterolitik melibatkan pembentukan dua bagian yang tidak sama.
Perbedaan utama antara pemecahan ikatan homolitik dan heterolitik adalah bahwa dalam pemecahan ikatan homolitik, satu elektron ikatan diberikan ke setiap fragmen, sedangkan dalam pemecahan ikatan heterolitik, dua elektron ikatan diberikan ke satu fragmen, dan fragmen lainnya tidak menerima elektron.
Apa itu Pemecahan Homolitik
Pemecahan homolitik adalah disosiasi ikatan kimia, membentuk dua fragmen yang sama. Dalam ikatan kimia kovalen, ada dua elektron dalam ikatan. Dalam jenis pemecahan seperti ini, kedua fragmen masing-masing mendapatkan satu elektron.
Ketika disosiasi ikatan terjadi pada molekul netral, dua fragmen mendapatkan satu elektron, masing-masing membentuk dua radikal bebas. Energi yang dibutuhkan untuk disosiasi ikatan homolitik, apakah itu diserap atau dilepaskan, dikenal sebagai energi disosiasi ikatan homolitik. Pemecahan ikatan homolitik terjadi dalam kondisi tertentu, seperti dengan adanya panas dan radiasi UV.
Pemecahan ikatan homolitik, juga dikenal sebagai ikatan homolisis atau pembelahan ikatan homolitik , biasanya membutuhkan sejumlah besar energi. Inilah sebabnya mengapa pemecahan ini terjadi dalam kasus berikut:
- Pirolisis senyawa karbon pada suhu yang sangat tinggi tanpa adanya oksigen.
- Mengatasi energi disosiasi ikatan untuk pemecahan heterolitik dengan menundukkan molekul ke jumlah panas yang dibutuhkan.
- Menundukkan molekul ke radiasi ultraviolet, yang sesuai dengan wilayah ultraviolet dari spektrum elektromagnetik.
Dalam kasus tertentu, pemecahan ikatan homolitik hanya membutuhkan sedikit panas. Salah satu contohnya adalah ikatan oksigen-oksigen dalam peroksida, yang relatif lemah dan memiliki energi aktivasi yang rendah, membutuhkan lebih sedikit panas.
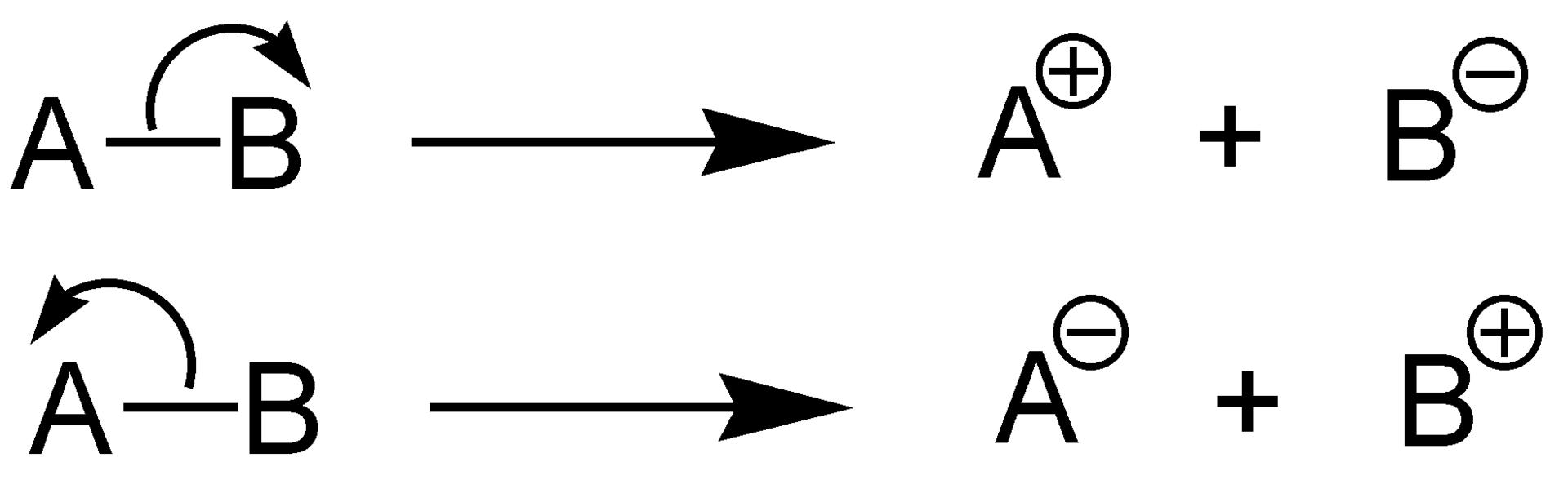
Apa itu Pemecahan Ikatan Heterolitik
Dalam pemecahan ikatan heterolitik, satu fragmen molekul mendapatkan dua elektron, sedangkan fragmen molekul lainnya tidak mendapatkan satu pun elektron. Kami menyebut proses ini heterolisis atau pembelahan heterolitik. Di sini, ikatan kovalen antara dua spesies kimia terurai dengan cara yang tidak serupa. Ini menghasilkan satu fragmen mendapatkan dua elektron, sedangkan fragmen lainnya tidak mendapatkan elektron.
Ketika sebuah molekul dengan molekul bermuatan netral tunduk pada pemecahan heterolitik, salah satu fragmen yang dihasilkan akan memiliki muatan negatif, sedangkan fragmen lainnya akan memiliki muatan positif. Fragmen bermuatan positif juga disebut kation. Fragmen ini adalah fragmen yang tidak mendapatkan satupun elektron dalam ikatan pemecahan. Molekul lainnya adalah anion, dan molekul ini mengandung kedua elektron dari ikatan perjanjian sebelumnya setelah pemecahan ikatan heterolitik.
Dalam pemecahan ikatan heterolitik, fragmen yang mendapatkan kedua elektron memiliki keelektronegatifan tertinggi dari kedua fragmen, memperoleh muatan negatif. Unsur yang lebih elektropositif tidak mengandung elektron ikatan; karenanya mendapat muatan positif. Selain itu, energi disosiasi ikatan heterolitik adalah energi yang dibutuhkan untuk memecah ikatan dalam proses pemecahan ikatan heterolitik.
Perbedaan Antara Pemecahan Ikatan Homolitik dan Heterolitik
Definisi
- Pemecahan homolitik adalah disosiasi ikatan kimia, membentuk dua fragmen yang sama.
- Pemecahan heterolitik adalah disosiasi ikatan kimia di mana satu fragmen molekul mendapatkan dua elektron, dan fragmen molekul lainnya tidak mendapatkan elektron.
Elektron ikatan
- Dalam pemecahan homolitik, setiap produk mendapat satu elektron.
- Dalam pemecahan heterolitik, hanya satu produk yang mendapat dua elektron, dan produk lainnya tidak mendapat elektron.
Produk
- Pemecahan homolitik melibatkan pembentukan dua produk yang sama.
- Pemecahan heterolitik melibatkan pembentukan produk yang tidak sama.
Energi
- Dalam pemecahan homolitik, energi yang dilepaskan atau diambil dikenal sebagai energi disosiasi ikatan homolitik.
- Dalam pemecahan heterolitik, energi ini dikenal sebagai energi disosiasi ikatan heterolitik.
Kesimpulan
Pemecahan adalah penghancuran ikatan kimia kovalen. Singkatnya, ada dua jenis pemecahan menurut pembentukan ikatan dan distribusi elektron. pemecahan ikatan heterolitik. Perbedaan utama antara pemecahan ikatan homolitik dan heterolitik adalah bahwa dalam pemecahan ikatan homolitik, satu elektron ikatan diberikan ke setiap fragmen, sedangkan dalam pemecahan ikatan heterolitik, dua elektron ikatan diberikan ke satu fragmen, dan fragmen lainnya tidak menerima elektron.
