Perbedaan Utama – Reaksi Oksidasi vs Reaksi Reduksi – Oksidasi dan reduksi adalah dua reaksi setengah reaksi redoks. Reaksi redoks adalah reaksi kimia yang terjadi melalui pertukaran elektron antar atom.
Perbedaan utama antara reaksi oksidasi dan reduksi adalah bahwa oksidasi peningkatan keadaan oksidasi atom sedangkan reduksi adalah penurunan keadaan oksidasi atom.
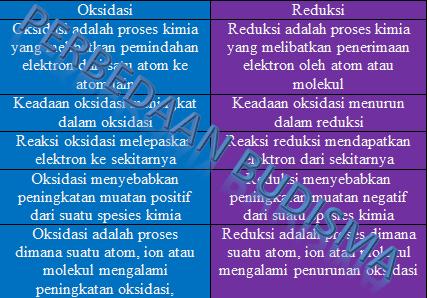
Tabel Perbandingan Oksidasi vs Reduksi
| Parameter Perbandingan | Oksidasi | Reduksi |
| Definisi | Oksidasi adalah proses kimia yang melibatkan pemindahan elektron dari satu atom ke atom lain | Reduksi adalah proses kimia yang melibatkan penerimaan elektron oleh atom atau molekul |
| Perubahan Status Oksidasi
|
Keadaan oksidasi meningkat dalam oksidasi | Keadaan oksidasi menurun dalam reduksi |
| Pertukaran Elektron | Reaksi oksidasi melepaskan elektron ke sekitarnya | Reaksi reduksi mendapatkan elektron dari sekitarnya |
| Perubahan Muatan Listrik | Oksidasi menyebabkan peningkatan muatan positif dari suatu spesies kimia | Reduksi menyebabkan peningkatan muatan negatif dari suatu spesies kimia |
| Keadaan Atom | Oksidasi adalah proses dimana suatu atom, ion atau molekul mengalami peningkatan oksidasi, | Reduksi adalah proses dimana suatu atom, ion atau molekul mengalami penurunan oksidasi |
| Hasil | Oksidasi menghasilkan oksigen dari atom | Reduksi menghasilkan atom dari oksigen |
| Spesies Kimia Terlibat | Oksidasi terjadi pada reduktor | Reduksi terjadi pada oksidator |
Apa itu Oksidasi?
Oksidasi adalah proses kimia yang melibatkan pemindahan elektron dari satu atom ke atom lain. Dalam proses ini, satu atom mengalami oksidasi karena kehilangan elektron dan atom lain yang menerima elektron mengalami reduksi.
Oksidasi dapat didefinisikan sebagai hilangnya elektron dari atom, molekul atau ion. Kehilangan elektron ini menyebabkan status oksidasi dari spesies kimia menjadi meningkat. Karena reaksi oksidasi melepaskan elektron, seharusnya ada spesies yang menerima elektron. Oleh karena itu, reaksi oksidasi adalah reaksi setengah reaksi besar.
Oksidasi suatu spesies kimia diberikan sebagai perubahan keadaan oksidasi. Oksidasi adalah bilangan dengan simbol positif (+) atau negatif (-) yang menunjukkan hilangnya atau perolehan elektron oleh atom, molekul atau ion tertentu.
Di masa lalu, istilah oksidasi diberi definisi “penambahan oksigen ke suatu senyawa.” Ini karena oksigen adalah satu-satunya zat pengoksidasi yang diketahui pada saat itu. Namun, definisi ini tidak lagi akurat karena ada lebih banyak reaksi oksidasi yang terjadi tanpa adanya oksigen. Sebagai contoh, reaksi antara Magnesium (Mg) dan Hydrochloric acid (HCl) tidak melibatkan oksigen, tetapi ini adalah reaksi redoks yang mencakup oksidasi Mg menjadi Mg2+.
Ada definisi historis lain untuk oksidasi yang melibatkan Hidrogen. Artinya, oksidasi adalah proses kehilangan ion H+ . Ini juga tidak akurat karena ada banyak reaksi yang terjadi tanpa pelepasan ion H+.
Oksidasi selalu meningkatkan status oksidasi suatu spesies kimia karena hilangnya elektron. Hilangnya elektron ini menyebabkan muatan atom atau molekul untuk diubah.
Apa itu Reduksi?
Reduksi dapat didefinisikan sebagai perolehan elektron dari atom, molekul atau ion. Perolehan elektron ini menyebabkan keadaan oksidasi dari spesies kimia menurun karena reduksi menciptakan muatan listrik negatif ekstra dalam atom. Untuk mendapatkan elektron dari luar, harus ada spesies donor elektron. Oleh karena itu, reduksi adalah reaksi kimia yang terjadi selama reaksi redoks. Reaksi reduksi adalah reaksi setengah.
Perbedaan Antara Reaksi Oksidasi dan Reduksi
Definisi
- Reaksi Oksidasi: Oksidasi dapat didefinisikan sebagai hilangnya elektron dari atom, molekul atau ion.
- Reaksi Reduksi: Reduksi dapat didefinisikan sebagai perolehan elektron dari atom, molekul atau ion.
Perubahan Status Oksidasi
- Reaksi Oksidasi: Keadaan oksidasi meningkat dalam oksidasi.
- Reaksi Reduksi: Keadaan oksidasi menurun dalam reduksi.
Pertukaran Elektron
- Reaksi Oksidasi: Reaksi oksidasi melepaskan elektron ke sekitarnya.
- Reaksi Reduksi: Reaksi reduksi mendapatkan elektron dari sekitarnya.
Perubahan Muatan Listrik
- Reaksi Oksidasi: Oksidasi menyebabkan peningkatan muatan positif dari suatu spesies kimia.
- Reaksi Reduksi: Reduksi menyebabkan peningkatan muatan negatif dari suatu spesies kimia.
Spesies Kimia Terlibat
- Reaksi Oksidasi: Oksidasi terjadi pada reduktor.
- Reaksi Reduksi: Reduksi terjadi pada oksidator.
Kesimpulan
Oksidasi dan reduksi adalah dua reaksi setengah reaksi redoks. Perbedaan utama antara oksidasi dan reduksi adalah bahwa oksidasi meningkatkan keadaan oksidasi atom sedangkan reduksi adalah penurunan keadaan oksidasi atom.

