Perbedaan utama: Massa atom hanyalah massa isotop spesifik, atau massa gabungan proton, neutron, dan elektron atom. Nomor atom adalah jumlah proton yang ditemukan dalam nukleus suatu unsur.
Anggap saja kimia itu membingungkan, berbagai jumlah unsur, nomor atom, ikatan, massa, berat, atom, dll.Semua kata-kata ini mulai kabur setelah jangka waktu tertentu sehingga seseorang tidak dapat lagi membedakan satu dari yang lain. Nah massa atom dan nomor atom adalah dua dari kata-kata yang sering membingungkan dan digunakan secara bergantian.
Massa atom hanyalah massa isotop spesifik. Isotop adalah varian dari unsur kimia tertentu. Semua isotop memiliki jumlah proton yang sama, tetapi jumlah neutron berbeda di setiap isotop. Massa atom mencakup massa gabungan proton, neutron, dan elektron atom. Massa atom kadang-kadang salah digunakan untuk menggambarkan massa atom relatif, massa atom rata-rata dan berat atom. Namun, mereka sedikit berbeda dari massa atom.
Massa atom adalah massa atom ketika diam. Ini karena ketika sebuah atom bergerak pada kecepatan yang sangat tinggi, ia cenderung bertambah massa. Meskipun menurut definisi, massa atom adalah massa semua proton, neutron, dan elektron, elektron terlalu kecil untuk membuat perbedaan signifikan dalam massa atom. Sebagian besar elemen pada tabel periodik memiliki isotop dan karena perbedaan jumlah neutron, massa setiap isotop juga berubah.
Massa atom diekspresikan menggunakan satuan massa atom atau amu. Satu satuan massa atom sama dengan 1/12th dari massa Carbon-12. Ketika massa atom dibagi dengan 1/12 dari massa Karbon-12, massa relatif elemen tersebut diperoleh. Namun, massa relatif suatu benda sebenarnya adalah berat atom suatu unsur, karena dihitung dengan mempertimbangkan semua isotop. Padahal, ini seharusnya tidak dianggap sebagai massa atom suatu unsur.

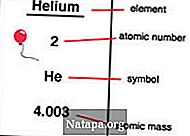
Nomor atom adalah jumlah proton yang ditemukan dalam nukleus suatu unsur. Ketika sebuah atom netral, itu berarti bahwa ia memiliki jumlah proton dan elektron yang sama. Nomor atom dilambangkan dengan Z. Karena setiap elemen memiliki jumlah proton yang berbeda, nomor ini juga digunakan untuk mewakili elemen. Isotop biasanya memiliki nomor atom yang sama tetapi diklasifikasikan menggunakan massa atomnya, misalnya Karbon-12, Karbon-13.
Elemen ditempatkan dalam urutan nomor atom pada tabel periodik. Nomor atom tercantum di sudut kiri atas elemen sebagai superscript. Nomor atom dapat membantu membuka informasi tentang elemen dan banyak orang dapat melihat nomor atom dan menyatakan elemen apa itu. Ia juga memberi tahu di mana dalam tabel periodik itu dapat ditempatkan dan apakah itu cair, gas atau padat. Nomor atom juga memberikan informasi mengenai muatan inti, keadaan oksidasi, perilaku ikatan, muatan ion, dll.
