Perbedaan Utama – Nomor Atom vs Nomor Massa. Atom terdiri dari elektron, proton, dan neutron. Proton dan neutron bersama-sama membentuk inti atom. Saat mengukur massa atom, kita sebenarnya mengukur massa inti. Itu karena massa elektron dapat diabaikan bila dibandingkan dengan proton atau neutron. Nomor atom dan nomor massa atom adalah dua istilah penting karena istilah-istilah ini memberi kita rincian tentang jumlah proton dan jumlah neutron yang ada dalam sebuah atom.
Perbedaan utama antara nomor atom dan nomor massa adalah bahwa nomor atom menunjukkan jumlah proton yang ada dalam sebuah atom sedangkan, nomor massa menunjukkan jumlah proton dan jumlah neutron yang ada dalam sebuah atom.
Pengertian Nomor Atom
Nomor atom adalah jumlah proton yang ada dalam atom. Proton berada di inti atom. Jumlah proton dalam atom adalah properti unik untuk unsur kimia. Oleh karena itu, kita dapat mengidentifikasi elemen kimia tertentu dengan mencari jumlah proton yang ada dalam atomnya. Setiap atom memiliki setidaknya satu proton. Misalnya, atom hidrogen hanya memiliki satu proton.
Karena nomor atom adalah jumlah proton, nomor atom tidak memiliki satuan. Sebagai contoh, jumlah proton dalam Helium adalah 2. Oleh karena itu, nomor atom Helium adalah 2. Biasanya, nomor atom diberikan bersama dengan simbol unsur kimia dengan cara tertentu.
Isotop adalah atom yang memiliki jumlah proton yang sama tetapi jumlah neutron yang berbeda. Karena isotop ini memiliki jumlah proton yang sama, mereka termasuk ke dalam unsur kimia yang sama. Karena itu, ketika kita berbicara tentang isotop, kita berbicara tentang berbagai bentuk elemen yang sama.
Proton adalah partikel subatom bermuatan positif. Oleh karena itu, nomor atom menunjukkan muatan positif total dari sebuah nukleus. Dalam atom netral, jumlah proton sama dengan jumlah elektron, karena, agar netral, semua muatan positif harus dinetralisir dari muatan negatif elektron. Oleh karena itu, nomor atom sama dengan jumlah elektron yang ada dalam atom netral.
Nomor atom suatu elemen dapat diubah jika elemen tersebut bersifat radioaktif. Itu karena, ketika beberapa elemen menjalani radioaktivitas, proton diubah menjadi partikel subatomik yang berbeda atau neutron dapat diubah menjadi proton. Itu mengubah jumlah proton hadir dalam sebuah atom. Ini berubah menjadi elemen yang berbeda (perubahan dalam nomor atom mengubah elemen).
Pengertian Nomor Massa
Nomor massa adalah jumlah dari jumlah proton dan neutron suatu atom. Ini berarti nomor massa adalah jumlah total partikel subatom yang ada dalam inti atom. Proton atau neutron saja disebut nukleon. Oleh karena itu, nomor massa juga dapat diberikan sebagai jumlah total nukleat yang ada dalam inti atom.
Ini disebut nomor massa karena menentukan massa atom. Massa atom adalah massa total proton dan neutron dari atom itu. Itu karena massa elektron dapat diabaikan bila dibandingkan dengan proton atau neutron.
Karena jumlah proton dan jumlah neutron sama dalam atom stabil, jumlah massa atom kira-kira sama dengan dua kali nomor atom. Namun, dalam isotop, jumlah massa mungkin atau mungkin tidak sama dengan dua kali nomor atom. Ini karena isotop memiliki jumlah proton yang sama tetapi jumlah neutron yang berbeda. Oleh karena itu, pada mereka, jumlah massa berbeda dari nilai yang diharapkan.
Selain itu, ada beberapa zat yang disebut isobar. Ini adalah atom-atom dari unsur-unsur yang berbeda yang memiliki jumlah massa yang sama, tetapi mereka berbeda dalam jumlah atomnya. Misalnya, Chlorine-37 dan Argon-37 memiliki nomor massa yang sama. Oleh karena itu, mereka adalah isobar.
Karena atom sering mengalami peluruhan alfa yang mengeliminasi dua proton dan dua neutron dari inti radioaktif, maka jumlah massa unsur dapat berubah. Maka jumlah massa diubah oleh 4 unit.
Perbedaan Antara Nomor Atom dan Nomor Massa
Definisi
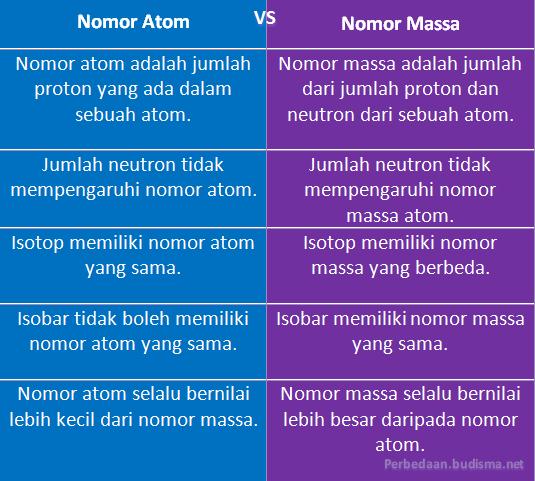
- Nomor Atom: Nomor atom adalah jumlah proton yang ada dalam sebuah atom.
- Nomor Massa: Nomor massa adalah jumlah dari jumlah proton dan neutron dari sebuah atom.
Jumlah Neutron
- Nomor Atom: Jumlah neutron tidak mempengaruhi nomor atom.
- Nomor Massa : Jumlah neutron tidak mempengaruhi nomor massa atom.
Isotop
- Nomor Atom: Isotop memiliki nomor atom yang sama.
- Nomor Massa: Isotop memiliki nomor massa yang berbeda.
Isobar
- Nomor Atom: Isobar tidak boleh memiliki nomor atom yang sama.
- Nomor Massa: Isobar memiliki nomor massa yang sama.
Nilai
- Nomor Atom: Nomor atom selalu bernilai lebih kecil dari nomor massa.
- Nomor Massa: Nomor massa selalu bernilai lebih besar daripada nomor atom.
Kesimpulan
Nomor atom dan nomor massa adalah rincian mendasar tentang atom. Nomor atom adalah nilai unik untuk elemen kimia tertentu. Tetapi bisa ada elemen yang memiliki nomor massa yang sama. Mereka disebut isobar. Dan juga, bisa ada atom yang memiliki nomor atom yang sama dengan nomor massa yang berbeda namun memiliki elemen yang sama. Mereka disebut isotop.
Perbedaan utama antara nomor atom dan nomor massa adalah bahwa nomor atom menunjukkan jumlah proton yang ada dalam sebuah atom sedangkan, jumlah massa menunjukkan jumlah jumlah proton dan jumlah neutron yang ada dalam sebuah atom.

